Por Cristián Marcelo Muñoz
Los modelos matemáticos permiten estimar la propagación de la epidemia y el impacto que tendrán las diferentes estrategias de intervención. Es así, que la diferencia entre no hacer nada y restringir el movimiento es de varios órdenes de magnitud.
Los modelos matemáticos se han convertido en herramientas importantes para analizar la propagación de epidemias y el diseño y evaluación de adecuadas medidas de intervención. La matemática detrás de estos modelos es similar a la que suelen usar los ingenieros en la representación de diferentes sistemas complejos.
La formulación de un modelo requiere de supuestos, variables y parámetros, y proporciona resultados conceptuales como umbrales y número de contagiados, hospitalizados y defunciones. En febrero de este año y luego de la aparición del COVID-19 en China, diversas publicaciones reportaron el ajuste de estos parámetros.
En este estudio calibro un modelo SEIR y reporto el número de contagiados y el tiempo de extensión de la epidemia, según diferentes estrategias que controlan el movimiento.
Matemática de una epidemia
La modelación matemática de la transmisión de enfermedades infecciosas creció de manera importante a partir de mediados del siglo XX, de aquí que una gran variedad de modelos han sido aplicados a diversas enfermedades infecciosas.
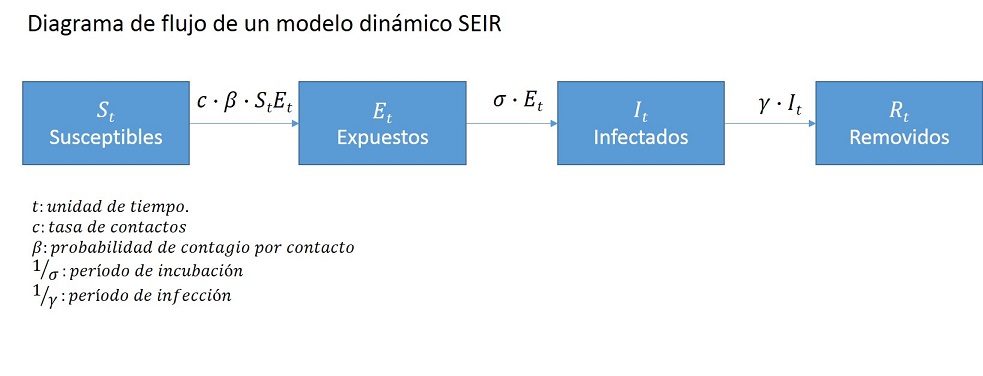
La formulación matemática consiste en representar la dinámica de la epidemia a través de un conjunto de ecuaciones diferenciales que actúan sobre una estratificación de la población anfitriona, la cual representa la dinámica de la transmisión de la infección.
Así, la población se estratifica como susceptibles (S), expuestos (E) sin síntomas pero con la infección en latencia, infectados (I) con síntomas, y removidos (R), ya sea porque sanaron o no lograron sobrevivir. Mientras más compleja sea la modelación, mayor será el número de estratos que incluirá, por ejemplo, Tang et. al (2020a y 2020b) proponen un modelo que además agrega los estratos infectados pero sin síntomas (A) y hospitalizados (H), lo que permite reflejar de manera más adecuada la dinámica hospitalaria y de cuarentena. Los acrónimos de los diferentes modelos frecuentemente se basan en el patrón de flujos entre los diferentes estratos, como por ejemplo, SI, SIR y SEIR, que son los modelos más usados1.
El flujo de la población entre estratos se modela a través de tasas de conversión. La tasa de contactos es c, mientras que β es la probabilidad de contagio por contacto y por unidad de población. La tasa de transición desde individuos expuestos, a infectados sintomáticos es σ, mientras que γ representa la tasa de individuos removidos.
El número básico de reproducción (R0) y de reemplazo (Rt)
El número básico de reproducción (R0), también llamado tasa básica de reproducción, es una medida epidemiológica utilizada para describir el contagio o la transmisibilidad de los agentes infecciosos. R0 se define como el número promedio de infecciones secundarias producidas cuando un individuo infectado se introduce en una población anfitriona donde todos son susceptibles.
Las estimaciones del valor de R0 suelen calcularse en función de la tasa de contacto, la probabilidad de infección por contacto entre una persona susceptible y un grupo de personas infectadas y la duración del contagio después de que una persona se infecta. El cálculo se puede hacer más complejo en la medida que se agregan parámetros adicionales que describen ciclos de transmisión más completos.
Delamater et al. (2019) destacan que al ser R0 una función de la tasa de contacto, su valor es una función del comportamiento y la organización social de una población determinada, así como de las características biológicas de cada patógeno. De aquí que, el uso de valores obtenidos de otras experiencias debe mirarse con cierto cuidado.
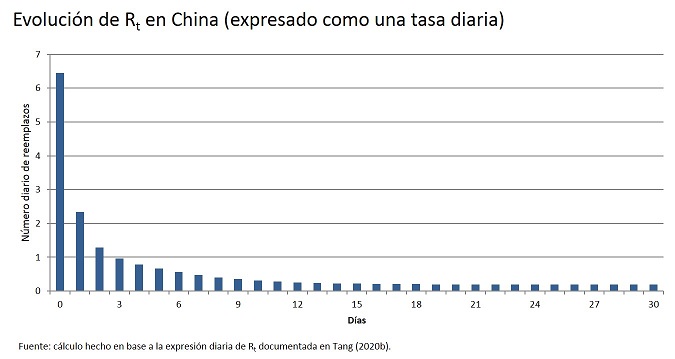
Si R0 >1, entonces la infección invadirá y persistirá en la población huésped, transformándose en una epidemia. Para el COVID-19 se ha documentado un número de reproducción promedio entre 2,0 y 4,9, sin embargo, Tang et al. (2020) reportan que podría ser tan alto como 6,47, valor reportado en los primeros días de la infección en China.
Por su parte, el número de reemplazo, Rt, es el número promedio de contagios secundarios producidos durante el período de duración de la infección. Rt cambia en función del tiempo, en donde la enfermedad va evolucionando. R0 y Rt son iguales sólo al inicio de la enfermedad. Algunos artículos también reportan este valor como una tasa diaria.
Estrategias de intervención
Las estrategias de intervención reducen Rt implementando, en diferentes grados, la restricción de la movilidad social. Según sea la estrategia, serán los cambios que ocurran en las tasas de contacto, diagnóstico y de cuarentena, parámetros que definen la dinámica del modelo.
La figura siguiente muestra la función de Rt calibrada por Tang et al (2020b) considerando la combinación de las diferentes medidas de control del movimiento implementadas en China a partir del 23 de enero de 2020.
Para efectos de este estudio he calibrado un modelo SEIR usando los parámetros que regulan la transición entre los diferentes estratos según algunas documentaciones aparecidas recientemente2. En particular, respecto de los períodos de incubación e infección existe una gama importante de valores, por ejemplo, Kong et. al (2020) reporta un período de incubación de 2 a 7 días y un período de infección de 2 a 10 días. En la modelación he considerado los valores documentados en Kucharski et al. (2020), de 5,2 y 2,9 días como períodos de incubación e infección respectivamente.
Se han simulado tres estrategias de control sobre el movimiento de la población, representadas por una evolución diferente de Rt. La primera es de libre movimiento, con Rt fijo en 2,4 en todo el período. La segunda estrategia restringe parcialmente el movimiento, es decir, mantiene Rt igual a 2,4 hasta el 31 de marzo, para luego cambiar a 1,30 por el resto del período. La tercera estrategia de control es algo más ambiciosa, ya que, a inicios de mayo, Rt se reduce a 0,9.
Resultados
La figura muestra el impacto de cada estrategia de control. Con libre movimiento, el peak de infectados, incluyendo a los expuestos en período de latencia y a los infectados con síntomas, llega a 4 millones y su ocurrencia se produciría a fines de junio ― cuadro a) en la figura ―. En la estrategia que restringe en algún grado el movimiento, el peak se reduce drásticamente a poco más de 500.000 individuos, 12,5% del valor máximo anterior, y se aplazaría a fines de octubre ― cuadro b) en la figura ―. Con un movimiento mucho más restringido, el peak llegaría en la segunda quincena de mayo a sólo 9.000 individuos, 0,2% del valor máximo reportado en la estrategia que no restringe el movimiento ― cuadro c) en la figura ―.
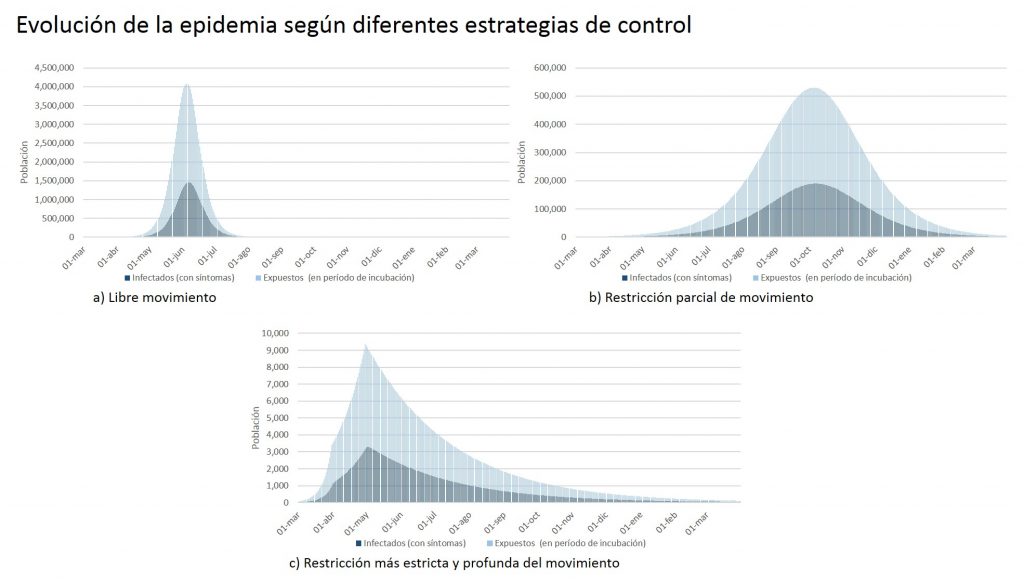
Es destacable notar que en las estrategias extremas, es decir, con libre movimiento y con una restricción estricta y profunda del movimiento, los peores momentos de la epidemia ocurren antes de julio. Sin embargo, con la estrategia intermedia, es decir, limitar parcialmente el movimiento, a pesar de que se reduce considerablemente el peak de infectados, la epidemia se prolonga hasta casi fines de año, y con ello sus consecuencias en la salud, comportamiento social y economía.
Los resultados son altamente sensibles a los parámetros que se usen. Por ejemplo, si se usan los valores medios reportados en Kong et. al (2020) de 4,8 y 6,9 días para los período de incubación e infección respectivamente, los tiempos de la epidemia son bastante mayores a los mostrados en la figura anterior.
Conclusiones
Dependiendo de cuál sea la estrategia de control que aplique el Gobierno, los efectos en la salud de la población, cambian en órdenes de magnitud. Es así que, al restringir parcialmente el movimiento, el peak de infectados cae a un 12,5% y su ocurrencia se posterga en varios meses, sin embargo, no es suficiente para evitar el colapso del sistema hospitalario, ya que, la tasa de hospitalización alcanzaría al 13,3% de los infectados, documentada en Tang et al. (2020b), para un total de 38.000 camas, de las cuales, sólo 1.200 son camas UTI que disponen de ventiladores.
Por su parte, la estrategia que restringe completamente el movimiento de la población por uno o dos meses, si bien, al inicio, presenta un elevado costo económico y social, reduce el peak a sólo un 0,2%, permitiendo una respuesta exitosa del sistema hospitalario. Sin embargo, el éxito de esta estrategia depende de la rigurosidad con la que se ejecute la medida, debiendo complementarse con frecuentes y rápidos test de detección que permitan aislar oportunamente los nuevos focos de contagio3,4.
En definitiva, contar con buenas herramientas matemáticas permite que las autoridades diseñen las mejores estrategias para enfrentar el COVID-19. Los recientes reportes de la experiencia China y Coreana permiten calibrar y mejorar los modelos matemáticos ya existentes de esta epidemia. Por ejemplo, la tasa de contactos en la población anfitriona se suele modelar según un comportamiento esperado, sin embargo, la heterogeneidad de la población puede representarse con una segregación en múltiples subgrupos, de modo de reflejar de mejor manera sus patrones de comportamiento. Otros enfoques incluyen métodos probabilísticos más complejos de la heterogeneidad de la población anfitriona5. Asimismo, se pueden agregar módulos que permitan representar de manera más completa la dinámica hospitalaria.
La industria también se puede beneficiar de la experiencia ganada en otros países, ya que, al contar con mejores estimaciones de la duración y profundidad de la epidemia, podrán programar de mejor modo sus flujos de caja, cumplimento de obligaciones financieras y niveles de ausentismo laboral. En definitiva, sin mucha dificultad, una buena modelación permitiría probar estrategias alternativas y evaluar sus resultados.
Referencias
[1] Delamater P., E. J. Street, T. F. Leslie, Y. T. Yang, y K. H. Jacobsen, Complexity of the Basic Reproduction Number (R0), Emerg Infect Disease 2019. Disponible en https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6302597/
[2] Euronews, Germany ‘increases its COVID-19 tests to 500,000 per week’, marzo de 2020.
[3] Goh G., Epidemic Calculator, 2020, accesible en http://gabgoh.github.io/COVID/index.html
[4] Kong L., J. Wang, W. Han y Z. Cao, Modeling Heterogeneity in Direct Infectious Disease Transmission in a Compartmental Model, International Journal of Environmental Research and Public Health, Int. J. Environ. Res. Public Health 2016, 13, 253; doi:10.3390/ijerph13030253, febrero de 2016.
[5] Kucharski A, T. W Russell, C. Diamond, Y. Liu, CMMID nCov working group, W. J. Edmunds, S. Funk y R. Eggo, Analysis and projections of transmission dynamics of nCoV in Wuhan, Centre for Mathematical Modeling of Infection Diseases, febrero de 2020.
[5] Kucharski A, T. W Russell, C. Diamond, Y. Liu, CMMID nCov working group, W. J. Edmunds, S. Funk y R. Eggo, Analysis and projections of transmission dynamics of nCoV in Wuhan, Centre for Mathematical Modeling of Infection Diseases, febrero de 2020.
[7] Tang B, N. L. Bragazzi, Q. Li, S. Tang, Y. Xiao, y J. Wu, An updated estimation of the risk of transmission of the novel coronavirus (2019-nCov), Infectious Disease Modelling 5 (2020) 248e255, febrero de 2020b.
[8] Vynnycky E. y R. G. White, Introduction to Infectious Disease Modelling, ResearchGate, Agosto 2014.
[9] Wu J. T., K. Leung, G. M. Leung, Nowcasting and forecasting the potential domestic and international spread of the 2019-nCoV outbreak originating in Wuhan, China: a modelling study, www.thelancet.com Vol 395, febrero de 2020.
Notas
- Vynnycky y White (2016) y Goh (2020). ↩
- Kucharski et al. (2020), Kong et al. (2020) y Tang et. al. (2020a). ↩
- La rapidez en la detección es crucial. Sin embargo, en Chile no todos los laboratorios que realizan el test de detección del virus están aprobados por el ISP, de modo que deben esperar la certificación de este organismo. Es decir, si en un hospital resulta un test positivo, de todos modos tiene que ir una muestra al ISP lo que retrasa todo el proceso de aislamiento en, al menos, 5 días. ↩
- Alemania ha incrementado la tasa de detección del virus a 500.000 por semana (Euronews 2020). ↩
- Kong et al. (2016). ↩
Cristián Marcelo Muñoz
Fundador de Breves de Energía. Email de contacto cmmunozm@brevesdeenergia.com.
Deseo agradecer los valiosos comentarios de Alexander Galetovic (profesor de economía de la Universidad Adolfo Ibáñez), Osvaldo Ledezma (ingeniero civil industrial y consultor asociado de BdE) y Marcela Rodríguez (médico cirujano).
© Breves de Energía. Todos nuestros desarrollos son originales, y están protegidos por la ley chilena de propiedad intelectual. La suscripción da derecho al suscriptor a usar personalmente el material, sin embargo, no permite su circulación a terceras personas ni su reproducción parcial o total. Cualquier uso del material de Breves de Energía sin autorización expresa está estrictamente prohibido.





One Response Comment
Muy interesante el artículo. Ojala logren darle mas difusión en nuestro país donde muchos hablan, todos critican y creen ser los únicos que están en lo correcto, sin hacer un análisis un poco mas científico y aprovechar las herramientas que la ciencia nos entrega.